نظام MedNNS: اختيار نموذج الذكاء الاصطناعي الأمثل للصور الطبية
الاثنين، 29 سبتمبر 2025
إذا كنت تستخدم نماذج الذكاء الاصطناعي لتقديم خدمات الرعاية الصحية اليوم، فربما لا تزال تقضي أسابيع في اختبار بنى الرؤية الحاسوبية وسيناريوهات مسبقة التدريب لكل مهمة تصوير جديدة. يعني اختيار البنية الهندسية الخاطئة للنموذج أن التدريب سيستغرق وقتاً طويلاً بينما تتوقف الدقة عند مستوى معين؛ إلى جانب أن البدء من أوزان مدربة مسبقة غير مناسبة قد يجعل الشبكة عاجزة عن التعرّف على الأنماط الصحيحة. وونظراً لاختلاف صورة الأشعة السينية تماماً عن صورة قطة مثلاً، فإن الاعتماد على ImageNet (مجموعة الصور التقليدية المستخدمة في التدريب المسبق) في المجال الطبي يعد رهاناً محفوفاً بالمخاطر.
هذه هي المشكلة اليومية التي يستهدفها نظام MedNNS الذي سيُعرض في المؤتمر الدولي الثامن والعشرين لحوسبة الصور الطبية والتدخل المدعوم بالحاسوب في كوريا الجنوبية، والذي يعدُ بإنهاء نهج التخمين (التجربة والخطأ) في بناء نماذج الذكاء الاصطناعي للتصوير الطبي من خلال إعادة صياغة اختيار النموذج كمشكلة استرجاع (أي البحث عن أفضل خيار من بين مجموعة خيارات موجودة مسبقاً، بدلاً من البدء من الصفر): عند توفر مجموعة بيانات طبية جديدة، يوصي MedNNS بالبنية والتهيئة الأكثر احتمالًا لتحقيق أفضل أداء، قبل أن يبدأ في استهلاك دورات وحدة معالجة الرسوميات. يقول المؤلف المشارك وطالب الدكتوراه في جامعة محمد بن زايد للذكاء الاصطناعي لطفي. “فكّر فيه كأنه وسيط زواج: أنت تقدم مجموعة البيانات، وهو يبحث في بياناته، ويسترجع لك أفضل المرشحين لتبدأ التدريب من نقطة قوية”.
طريقة عمل نظام MedNSS
تختلف الصور الطبية عن الصور اليومية: الأشعة السينية ذات التدرج الرمادي، صور الأنسجة المجهرية، أو التصوير المقطعي البصري فهي لا تشبه الصورة التي التقطتها مع كلبك أثناء التنزه. ولهذا السبب، فإن الميزات البصرية التي تُستخلص بسهولة من الصور العادية غالباً ما تكون غير قابلة للتطبيق أو محدودة الفائدة في الصور الطبية، مما يجعل ميزة التدريب المسبق على ImageNet مجرد وهم.
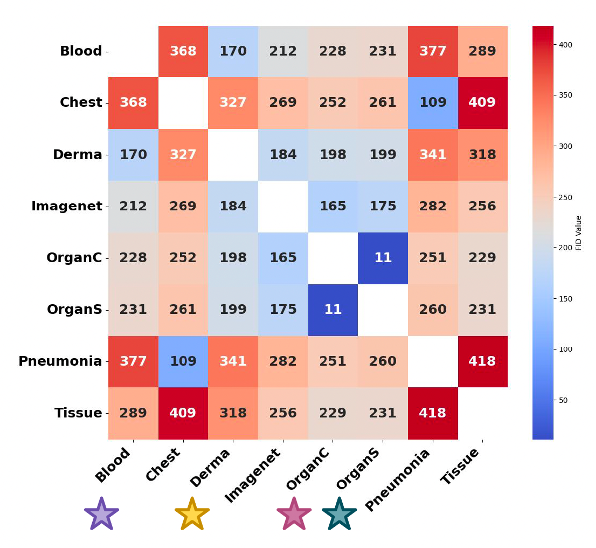
يقيس الفريق في الورقة البحثية، هذه الحقيقة باستخدام مسافة بداية فريشيه (مقياس يستخدم لتقييم جودة الصور) لكل مجموعة بيانات من MedMNIST، هناك عادةً مجموعة بيانات طبية أخرى أقرب إليها (مسافة بداية فريشيه أقل) من ImageNet، مما يدل على أن التدريب المسبق على بيانات قريبة من المجال الطبي يعطي نتائج أفضل. كما يقدمون دليلًا عملياً: التدريب المسبق على أقرب مجموعة بيانات طبية يسرّع التعلم ويحسّن النتيجة النهائية مقارنة ب ImageNet.
يستخدم MedNNS (وهو نظام للبحث عن أفضل بنية لنموذج الذكاء الاصطناعي الطبي) في جوهره نموذجاً شاملاً من نوع Once-For-All (OFA) يشبه “ResNet”، مدرّباً بجدول زمني لأخذ عينات يراعي الإنصاف للحفاظ على ترتيب الشبكات الفرعية عند مشاركة الأوزان بينها.
MedNNS هو أول إطار عمل – بحسب المؤلفين – يقوم بعملية تحسين مشترك لقرارين لمجموعة بيانات طبية مستهدفة: البنية الهندسية للنموذج، والأوزان المدربة مسبقاً. ويحقق ذلك من خلال بناء ما يُعرف بـ الفضاء الوصفي. يمكن تخيل هذا الفضاء كخريطة ذكية متعلمة، حيث يتم وضع بصمات رقمية (تضمينات متجهة) لكل مجموعة بيانات، ولكل نموذج محتمل، بهدف إيجاد أفضل توافق بينهما لتحقيق أعلى أداء ممكن. يتميز حجم مستودع النماذج بحجم كبير؛ حيث تحتوي على حوالي 720 ألف زوج من النماذج ومجموعات البيانات، مقارنةً بحوالي 14 ألف زوج فقط في أساليب البحث السابقة (أي أنها أكبر بحوالي 51 مرة). في هذه المساحة الواسعة، يشير القرب بين النموذج ومجموعة البيانات إلى أداء أفضل؛ فالنماذج الموجودة بالقرب من مجموعة بيانات معينة غالباً ما تتدرب بشكل أسرع وتحقق نتائج أعلى عليها. وعند تطبيق النموذج على بيانات جديدة (عملية الاستدلال)، يتم تحويل مجموعة بيانات المستشفى الجديدة إلى “بصمة رقمية ” ثم مقارنتها بالخريطة لاسترجاع أفضل النماذج المتاحة.
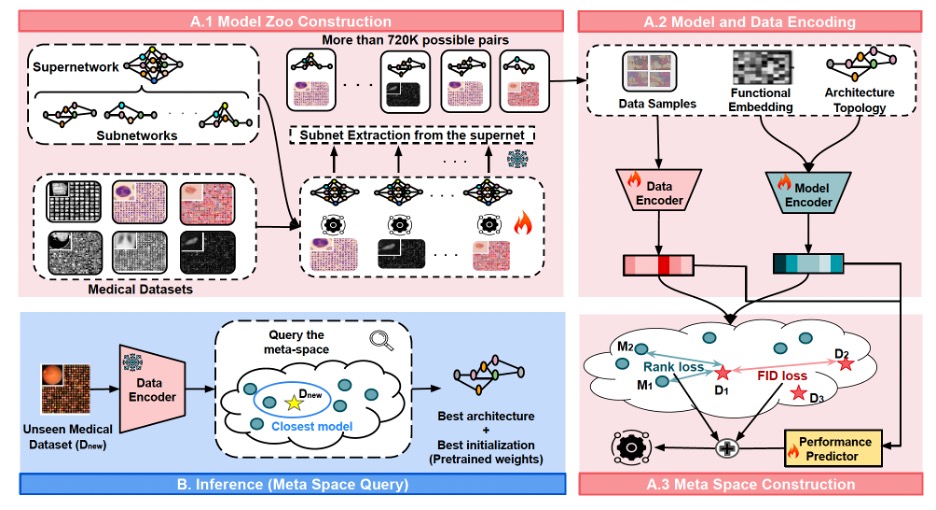
يقدم نظام MedNNS ثلاث طرق مختلفة لاسترجاع واختيار النموذج الأنسب، ولكل منها استراتيجية مختلفة:
- T1: اختيار النموذج الأقرب والأكثر تطابقاً ويقوم بتدريبه.
- T5 أو :T10 إعادة قائمة مختصرة من 5 أو 10 نماذج، يتم ضبطها ضبطاً دقيقاً لفترة قصيرة (حوالي حقبة واحدة)، ثم متابعة التدريب مع أفضل نموذج.
هذه الطريقة توازن بين السرعة والأمان عند التعامل مع أنواع جديدة وغير مألوفة من البيانات الطبية.
الأنظمة السابقة كانت تستهلك موارد ضخمة لأنها تدرب أعداداً هائلة من أزواج النماذج–مجموعات البيانات لملء جداول البحث. أما MedNNS فيقوم بتدريب شبكة فائقة واحدة لكل مجموعة بيانات، وهي نموذج كبير مفرط التوسيع (هنا شبكة Once-For-All / OFA)، ثم يستخرج آلاف الشبكات الفرعية عن طريق إخفاء الطبقات والقنوات، مع إعادة استخدام الأوزان عبر تقنية مشاركة الأوزان. هذا ينتج مستودع نماذج يضم حوالي 720 ألف زوج نموذج–مجموعة بيانات (أكبر بنحو 51 مرة من الأعمال السابقة) دون الحاجة لتدريب 720 ألف نموذج منفصل. والأهم أن الفريق يدرب الشبكة الفائقة بطريقة تحافظ على ترتيب الشبكات الفرعية، بحيث يكون النموذج الأفضل أثناء الاستخراج هو الأفضل عند تدريبه من الصفر (مع معامل ارتباط الرُّتب لسبيرمان يبلغ حوالي 90%).
يقول لطفي: “بوجود 720 ألف زوج بدلاً من 14 ألف، تحصل على صورة أوضح لما يناسب كل حالة، وتصبح التوصيات موثوقة وليست مجرد حظ”.
يتكون التضمين المتجهي للنموذج من بصمتين؛ متجه معماري (العمق، العرض، نسب التوسع) ومتجه وظيفي (استجابة الميزات قبل الأخيرة لمدخل ثابت)، يمر عبر شبكة عصبية صغيرة متعددة الطبقات. أما التضمين المتجهي لمجموعة البيانات فيعتمد على متوسط الميزات من دفعة عشوائية من الصور، ثم تمر عبر شبكة عصبية أخرى.
يوجد أداة صغيرة لتقدير الأداء تتعلم العلاقة بين أزواج النماذج ومجموعات البيانات، مما يسمح بالتنبؤ بالدقة المتوقعة. لكن البنية الحقيقية تنبع من خسارتين إضافيتين يضيفهما المؤلفون أثناء تدريب الفضاء الوصفي: الخسارة الأولى هي خسارة الترتيب والتي تفرض ترتيباً هرمياً بحيث تكون النماذج الأفضل أداءً أقرب إلى مجموعة البيانات المستهدفة، أما الخسارة الثانية فهي خسارة مسافة بداية فريشيه، والتي تقرّب مجموعات البيانات المتشابهة من بعضها البعض في الفضاء، بحيث تنتقل الخبرة عبر المهام ذات الصلة.
وقد أثبتت التجارب تفوق هذا النهج المزدوج على استخدام أي من الخسارتين بشكل منفصل، أو حتى على الأساليب التقليدية. ونتيجة لذلك، ينشأ فضاء مستمر حيث يعكس القرب المكاني بشكل مباشر الأفضلية في الأداء.”
أين يتفوق MedNNS وأين يمكن تحسينه
يُظهر MedNNS قدرات مثيرة للإعجاب، خاصة على مجموعات البيانات ضمن عائلة MedMNIST (مثل الالتهاب الرئوي، والأعضاء، والأنسجة، والأمراض الجلدية، والدم، والثدي). يتقارب بسرعة ويحقق نتائج قوية:
- السرعة: عند الحقبة 10، غالباً يطابق أو يتفوق على دقة المنافسين عند الحقبة 100، وهو مؤشر على سرعة الوصول إلى نموذج قابل للاستخدام
- الدقة: متوسط زيادة قدرها 1.7 نقطة مئوية مقارنة بالنماذج المعتمدة على ImageNet و أحدث أساليب البحث عن البنى العصبية (NAS)، مع أكبر المكاسب عندما يتوفر تدريب مسبق مشابه للمجال الطبي.
- الاستقرار: القوائم المختصرة T5/T10 تمنح دفعة إضافية وتقلل المخاطر مع مجموعات البيانات غير المألوفة.
من الناحية السريرية، قد تكون نتيجة السرعة هي الأهم: تقليل وقت استخدام وحدات معالجة الرسوميات يعني خفض التكلفة وتسريع التشغيل عند تغيير أجهزة التصوير أو بدء برامج الفحص. يقول لطفي:
“المستشفيات لا تريد الانتظار لأسابيع. إذا استطعت الوصول إلى خط أساس قوي في غضون ساعات، فإن المشروع سينجح”.
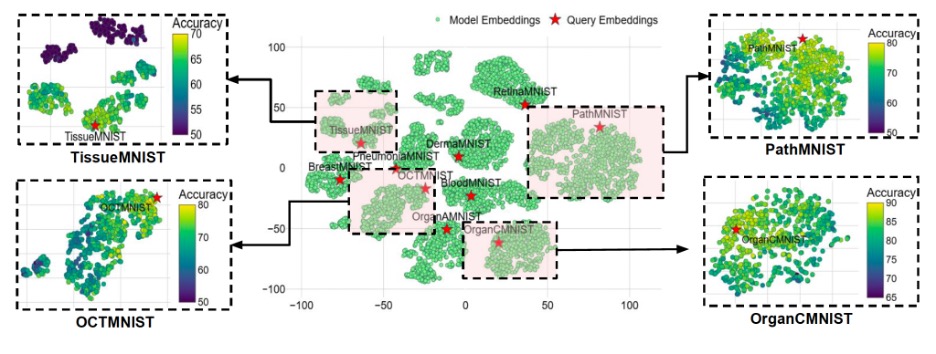
بعض مجموعات البيانات، مثل مجموعة بيانات (TissueMNIST)، تكون مختلفة جدًا عن غيرها (مسافة بداية فريشيه مرتفعة). هذا يجعل الطرق التقليدية لنقل المعرفة أقل فعالية، مما يقلل من ميزة نظام (MedNNS). الدرس المهم هو أنه بدلاً من تجنب استخدام (MedNNS)، يجب أن نعرف متى تكون بياناتنا “خارجة عن المألوف”. وفي حالة كانت مجموعة البيانات الجديدة غير مألوفة للفضاء الوصفي، يوصي الفريق ببدء التدريب من الصفر أو استخدام نموذج طبي أساسي أكبر.
كما أن مقياس مسافة بداية فريشيه ليس مثالياً. فقد صُمم للصور الطبيعية، ويمكن أن يخطئ في تقدير التشابه الطبي (قد تبدو مجموعتان من صور الأنسجة متقاربتين بينما تكونان مختلفتين سريرياً). يرى المؤلفون أن هناك مجالاً لتطوير مقاييس تشابه خاصة بالمجال الطبي حسب نوع التصوير، لكنهم يحذرون من أن المقاييس شديدة التخصص قد لا تكون قابلة للتعميم على كل الأشعة، وعلم الأمراض، والموجات فوق الصوتية.
يمكن للمستشفى استخدام نظام MedNNS اليوم من خلال رفع عينة صغيرة من مجموعة بياناتها للحصول على تضمينها المتجهي. بعد ذلك، يتم استعلام الفضاء الوصفي للحصول على توصيات T1/T5/T10 بأوزان مدربة مسبقاً. وأخيراً، تقوم بضبط النموذج أو النماذج المختارة وتشغيل النموذج الأنجح. بالنسبة للمستشفيات الإقليمية ذات الميزانيات المحدودة لوحدات معالجة الرسوميات، فإن الفائدة هي تخطي عشرات المحاولات الفاشلة. أما البرامج الوطنية فيمكنها استضافة فضاء وصفي مشترك بحيث تحصل المواقع في جميع أنحاء الدولة على اختيارات متسقة وقابلة للتكرار، وهو أمر مفيد لعمليات التدقيق والدراسات متعددة المواقع.
مستقبل MedNSS: من الصور إلى كل البيانات، ومن الدقة إلى التعامل مع القيود
يريد الباحثون في جامعة محمد بن زايد للذكاء الاصطناعي تطوير MedNNS في ثلاثة اتجاهات:
- التوسع إلى ما بعد التصنيف: توسيع الشبكات الفائقة والمشفّرات على مهام التجزئة والكشف، حيث يكون اختيار بنية وتصميم الشبكة أكثر أهمية.
- الاسترجاع المراعي للأجهزة: يتم وسم كل نموذج مرشح ببيانات حول استهلاك ذاكرة الفيديو، وزمن الاستجابة، واستهلاك الطاقة. هذا يمكّن العيادة من البحث عن: “أفضل نموذج يستهلك ذاكرة فيديو أقل من 8 جيجابايت” للحصول على نتائج مفلترة ومرتبة.
- دمج تقنيات التدريب الطبي الذاتي الإشراف والنماذج الأساسية ضمن مكتبة النماذج. بعد ذلك، سيتم ضبطها وتكييفها لكل مهمة على حدة، بالاعتماد على نفس منطق الفضاء الوصفي. (يقول الفريق إن هذا العمل جارٍ بالفعل.)
على المدى الطويل، يتصور لطفي أن الفضاء الوصفي سيكون حيوياً وتفاعلياً، تديره الشركات والجهات الرقابية والمستشفيات، ويتم تحديثه أولاً بأول مع وصول مجموعات بيانات جديدة، وسيقوم بفحص التحيزات الموجودة في البيانات عبر مختلف المجموعات السكانية وأنواع أجهزة التصوير. وسيقدم تقارير واضحة بمقاييس موحدة لضمان الشفافية للجميع.
MedNNS لا يُلغي ضرورة الفحص الدقيق، لكنه يستبدل التخمين بالتوجيه. يفعل النظام ذلك من خلال تحويل مهمة اختيار النموذج إلى عملية استرجاع داخل فضاء غني منظم ومليئ بالمعلومات، حيث يتم ترتيب الخيارات بناءً على مدى ملاءمتها للبيانات المتاحة. يمنح هذا فرق الذكاء الاصطناعي الطبي مساراً أسرع وأكثر موثوقية للانتقال من مجرد ” امتلاك مجموعة بيانات ” إلى امتلاك “نموذج يعمل.”
- الرعاية الصحية ,
- MICCAI ,
- مؤتمر ,
- التصوير الطبي ,
أخبار ذات صلة
جامعة محمد بن زايد للذكاء الاصطناعي تعلن عن شراكة بحثية استراتيجية مع "مينيرفا هيومانويدز" لتطوير روبوتات بشرية لتطبيقات قطاع الطاقة
تجسّد هذه الشراكة جسراً يربط بين أبحاث الذكاء الاصطناعي التأسيسية والتطبيقات الصناعية.
اقرأ المزيدلماذا ما زالت أنظمة الذكاء الاصطناعي اليوم عاجزة عن الاستدلال المكاني ثلاثي الأبعاد
A new benchmark by MBZUAI researchers shows how poorly current multimodal methods handle real-world geometric and perspective-based.....
- الاستدلال المكاني ,
- ثلاثي الأبعاد ,
- الأساس المعياري ,
- النماذج اللغوية-البصرية ,
- البحوث ,
- neurips ,
- المؤتمرات ,
السير مايكل برادي يدعو إلى انتقال الذكاء الاصطناعي الطبي من التشخيص إلى شرح القرارات
في إطار سلسلة المحاضرات المتميزة في جامعة محمد بن زايد للذكاء الاصطناعي، ناقش السير مايكل برادي مستقبل.....
- محاضرة زائر ,
- علم الأورام ,
- الاستدلال السببي ,
- الحرم الجامعي ,
- الطب ,
- الرعاية الصحية ,
- الرؤية الحاسوبية ,